SARS-CoV-2: Una descripción general de la estructura, transmisión y detección del virus
El SARS-CoV-2, el agente causante de la COVID-19, es un betacoronavirus de ARN monocatenario con envoltura.1-3 Se han identificado 7 coronavirus como agentes de infección humana, causando enfermedades que van desde el resfriado común leve a la insuficiencia respiratoria grave.4 Los coronavirus comparten las 4 proteínas estructurales: pico (S), envoltura (E), membrana (M) y nucleocápside (N), siendo las últimas las más abundantes.5-8
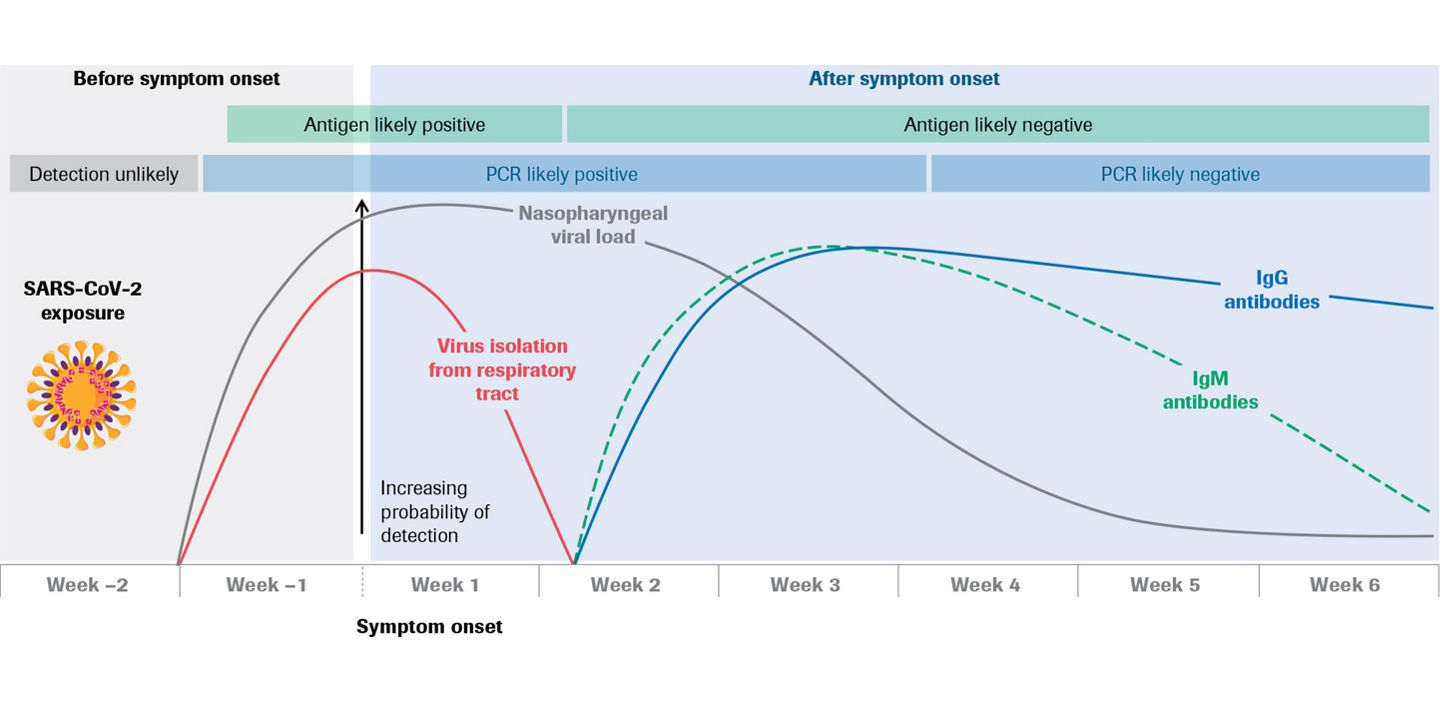
El SARS-CoV-2 se transmite principalmente de persona a persona a través de gotículas respiratorias y aerosoles.9,10 El periodo de incubación desde la infección hasta la carga viral detectable en el huésped suele oscilar entre 2 y 14 días.11,12 La detección de la carga viral puede asociarse con la aparición de signos y síntomas clínicos, aunque una proporción considerable de personas sigue siendo asintomática o ligeramente sintomática.13-15 El intervalo durante el cual un sujeto con COVID-19 es infeccioso aún no se ha establecido con claridad; sin embargo, se ha descrito bien la transmisión de individuos sintomáticos, asintomáticos y presintomáticos.16-18
Una estrategia eficaz para controlar la pandemia de la COVID-19 es desarrollar métodos muy precisos para la identificación y el aislamiento de pacientes infectados por SARS-CoV-2.19 La confirmación diagnóstica de la infección aguda por SARS-CoV-2 puede basarse en la detección de secuencias únicas en el ARN vírico o en la detección de proteínas víricas en muestras de las vías respiratorias de sujetos infectados.20 Los antígenos virales solo se expresan cuando el virus se está replicando activamente, lo que hace que las pruebas de antígenos sean clínicamente útiles para la identificación de infecciones agudas o tempranas.21,22 Las investigaciones actuales sugieren una replicación activa del SARS-CoV-2 en la garganta con alta diseminación vírica en los primeros 5 días de la infección, y que el virus infeccioso podría aislarse de muestras respiratorias hasta los primeros 7-9 días después de la aparición de los síntomas, lo que indica la viabilidad potencial de la detección de antígenos mediante hisopos faríngeos.23-25 Este período de tiempo también coincide con el tiempo en el que generalmente se observa la carga viral más alta en sujetos infectados.14,26-28 Por lo tanto, el mejor rendimiento de las pruebas de antígenos se observa durante la aparición de los síntomas en sujetos sintomáticos y la fase inicial de la infección.20 En la evaluación de los contactos de las personas infectadas confirmadas se pueden considerar la realización de pruebas en sujetos levemente sintomáticos o asintomáticos.20 Las pruebas de antígenos también pueden formar parte de regímenes de pruebas regulares para identificar, aislar y, por lo tanto, filtrar a las personas actualmente infectadas, incluidas aquellas que son asintomáticas.29,30