Le test antigénique Elecsys® SARS-CoV-2 utilise des anticorps monoclonaux dirigés contre la protéine N du SARS-CoV-2 dans un test à double anticorps de type «sandwich» pour la détection qualitative du SARS-CoV-2 dans les échantillons des voies respiratoires supérieures.31,32
Elecsys® SARS-CoV-2 Antigen

SARS-CoV-2: Aperçu de la structure du virus, de sa transmission et de sa détection
Le SARS-CoV-2, l’agent responsable de la COVID-19, est un bétacoronavirus à ARN monocaténaire enveloppé.1-3 Sept coronavirus ont été identifiés comme agents d’infection humaine. Ils provoquent des maladies allant d’un léger rhume à une insuffisance respiratoire grave.4 Les coronavirus partagent les 4 protéines structurales: les protéines de pointe ou «spike» (S), de l’enveloppe (E), de la membrane (M) et de la nucléocapside (N), cette dernière étant la plus abondante.5-8
Le SARS-CoV-2 se transmet principalement de personne à personne par les gouttelettes respiratoires et les aérosols.9,10 La période d’incubation entre l’infection et une charge virale détectable chez l’hôte varie généralement de 2 à 14 jours.11,12 La détection de la charge virale peut être associée à l’apparition de signes et symptômes cliniques, bien qu’une proportion considérable d’individus reste asymptomatique ou légèrement symptomatique.13-15 L’intervalle pendant lequel un individu atteint de COVID-19 est infectieux n’a pas encore été clairement établi, mais la transmission à partir d’individus symptomatiques, asymptomatiques et présymptomatiques a été bien décrite.16-18
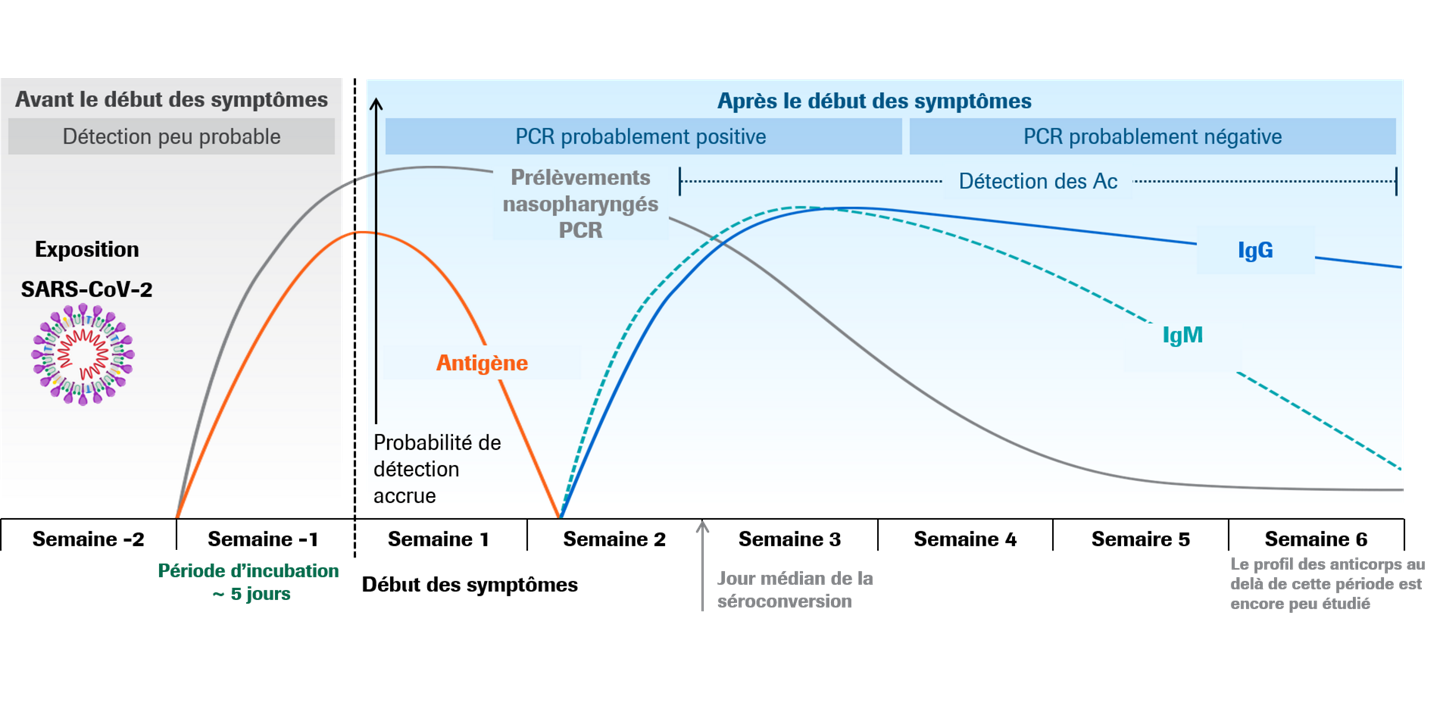
Une stratégie efficace pour contrôler la pandémie de COVID-19 consiste à développer des méthodes très précises pour l’identification et l’isolement des patients infectés par le SARS-CoV-2.19 La confirmation diagnostique de l’infection aiguë par le SARS-CoV-2 peut être basée sur la détection de séquences uniques dans l’ARN viral ou la détection de protéines virales dans les échantillons des voies respiratoires des personnes infectées.20 Les antigènes viraux ne sont exprimés que lorsque le virus se réplique activement, ce qui rend les tests antigéniques utiles sur le plan clinique pour l’identification d’une infection aiguë ou précoce.21,22 Les recherches actuelles suggèrent une réplication active du SARS-CoV-2 dans la gorge avec une forte excrétion virale au cours des 5 premiers jours de l’infection. Le virus infectieux a pu être isolé à partir d’échantillons respiratoires jusqu’aux 7 à 9 premiers jours suivant l’apparition des symptômes, ce qui indique que la détection d’antigènes en utilisant des prélèvements de gorge est potentiellement possible.23-25 Cette période coïncide également avec le moment où la charge virale la plus élevée est généralement observée chez les individus infectés.14,26-28 Par conséquent, la meilleure performance des tests antigéniques est approximativement observée au moment de l’apparition des symptômes chez les individus symptomatiques et au moment de la phase initiale de l’infection.20 Les tests effectués sur des individus légèrement symptomatiques ou asymptomatiques peuvent être envisagés dans l’évaluation des contacts des cas d’infection confirmée.20 Les tests antigéniques peuvent également faire partie des schémas de tests réguliers pour identifier, isoler et donc filtrer les personnes actuellement infectées, y compris celles qui sont asymptomatiques.29,30
Structure du coronavirus 2 du syndrome respiratoire aigu sévère (SARS-CoV-2)
- Protéine de la nucléocapside (N)
- Protéine de l’enveloppe (E)
- Protéine de pointe (protéine «spike») (S)
- Protéine de la membrane (M)
- ARN

* préparé selon la SOP DSR-052-05 des CDC; ** entre les analyses; # coefficient de variation
Limite de détection (LoD)31,32
La limite de détection (LoD) dans différents milieux de transport a été déterminée par des études de dilution limite utilisant un lysat viral inactivé (USA-WA1/2020). La LoD est définie comme la plus faible concentration détectable de SARS-CoV-2 à laquelle un minimum de 19 réplications par concentration sur 20 génèrent un résultat de test réactif (≥1,0 COI). Elle est exprimée en TCID50*/mL.
| Milieu de transport | TCID50/mL |
| COPAN Universal Transport Medium (UTM-RT) | 22,5 |
| CDC Viral Transport Medium | 22,5 |
| Solution saline stérile (NaCl 0.9 %) | 37.5 |
Sensibilité relative31,32
La sensibilité relative a été évaluée en utilisant 232 échantillons d’écouvillonnage nasopharyngé et 158 échantillons d’écouvillonnage oropharyngé prélevés chez des personnes présentant des signes et des symptômes évocateurs de la COVID-19 après une exposition connue ou suspectée au SARS-CoV-2 et chez des personnes soumises à un dépistage avant leur hospitalisation pour une intervention chirurgicale non liée à une maladie infectieuse.
Toutes les personnes incluses dans l’analyse ont été testées positives en utilisant le test de RT-PCR cobas® SARS-CoV-233. Les échantillons positifs à la RT-PCR ont ensuite été stratifiés en utilisant les valeurs du cycle de seuil (Ct) de la cible 2 (détection du gène de la protéine structurale de l’enveloppe E/ pan-sarbecovirus).
La figure ci-dessous met en corrélation les performances du test antigénique Elecsys® SARS-CoV-2 dans tous les échantillons RT-PCR-positifs provenant d’individus symptomatiques et asymptomatiques avec les valeurs Ct du test cobas® SARS-CoV-2.

* détection du gène de la protéine structurale de l’enveloppe E/ pan-sarbecovirus; ** N (cumulatif): réactif en utilisant le test antigénique Elecsys® SARS-CoV-2/total
Le tableau ci-dessous présente des analyses supplémentaires basées sur le nombre de jours suivant l’apparition des symptômes (DPSO – days post-symptom onset) et une stratification en fonction d’une valeur Ct de 30 avec le test cobas® SARS-CoV-2. La sensibilité relative globale obtenue chez les personnes symptomatiques présentant une valeur Ct de la cible 2 <30 avec le test cobas® SARS-CoV-2 a été de 94,5 % (IC bilatéral à 95 %: 90,4 – 97,2 % [189/200]).
| Cohorte | Ct avec cobas® SARS-CoV-2 <30 | Ct avec cobas® SARS-CoV-2 ≥30 | ||||
| N | Non réactif | Sensibilité (IC à 95 %§) | N | Non réactif | Sensibilité (IC à 95 %§) | |
| Symptomatique; ≤5 DPSO | 119 | 3 | 97,5 % (92,8 – 99,5 %) | 30 | 8 | 26,7 % (12,3 – 45,9 %) |
| Symptomatique; ≤10 DPSO | 158 | 8 | 94,9 % (90,3 – 97,8 %) | 78 | 18 | 23,1 % (14,3 – 34,0 %) |
| Symptomatique; >10 DPSO | 4 | 1 | 75,0 % (19,4 – 99,4 %) | 18 | 3 | 16,7 % (3,6 – 41,4 %) |
| Symptomatique; DPSO inconnu | 38 | 2 | 94,7 % (82,3 – 99,4 %) | 17 | 4 | 23,5 % (6,8 – 49,9 %) |
| Exposition connue ou suspectée | 14 | 3 | 78,6 % (49,2 – 95,3 %) | 34 | 1 | 2,9 % (0,1 – 15,3 %) |
| Dépistage | 12 | 3 | 75,0 % (42,8 – 94,5 %) | 17 | 1 | 5,9 % (0,2 – 28,7 %) |
Le graphique suivant résume la sensibilité relative du test antigénique Elecsys® SARS-CoV-2 dans les échantillons de RT-PCR positifs prélevés chez des patients symptomatiques stratifiés en fonction du nombre de jours après l’apparition des symptômes et une valeur Ct de la cible 2 de 30 avec le test cobas® SARS-CoV-2.

Spécificité relative31,32
La spécificité relative du test antigénique Elecsys® SARS-CoV-2 a été évaluée en utilisant 2747 échantillons d’écouvillonnage naso/oropharyngé négatifs à la RT-PCR prélevés chez des personnes présentant des signes et symptômes évocateurs de la COVID-19 après une exposition connue ou suspectée au SARS-CoV-2 et chez des personnes soumises à un dépistage avant leur hospitalisation pour une intervention chirurgicale non liée à une maladie infectieuse.
| Cohorte | N | Réactif | Spécificité (IC à 95 %) |
| Symptomatique | 548* | 0 | 100% (99,3 – 100%) |
| Exposition connue/suspectée et dépistage | 2199** | 4 | 99,8% (99,5 – 100 %) |
| Total | 2747 | 4 | 99,9 % (99,6 – 100 %) |
Estimation de l’évolution des marqueurs lors de l’infection par le SARS-CoV-227,30
Références
- 1. Zhou P. et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin. Nature. 2020 Mar;579(7798):270-273. doi: 10.1038/s41586-020-2012-7. Epub 2020 Feb 3.
- Wu F. et al. A new coronavirus associated with human respiratory disease in China. Nature. 2020 Mar;579(7798):265-269. doi: 10.1038/s41586-020-2008-3. Epub 2020 Feb 3.
- Coronaviridae Study Group of the International Committee on Taxonomy of Viruses. The species Severe acute respiratory syndrome-related coronavirus: classifying 2019-nCoV and naming it SARS-CoV-2. Nat Microbiol. 2020 Apr;5(4):536-544. doi: 10.1038/s41564-020-0695-z. Epub 2020 Mar 2.
- Ye ZW. et al. Zoonotic origins of human coronaviruses. Int J Biol Sci 2020 Mar 15;16(10):1686-1697. doi: 10.7150/ijbs.45472. eCollection 2020.
- Yoshimoto FK. The Proteins of Severe Acute Respiratory Syndrome Coronavirus-2 (SARS CoV-2 or n-COV19), the Cause of COVID-19. Protein J. 2020 Jun;39(3):198-216. doi: 10.1007/s10930-020-09901-4.
- Naqvi AAT. et al. Insights into SARS-CoV-2 genome, structure, evolution, pathogenesis and therapies: Structural genomics approach. Biochim Biophys Acta Mol Basis Dis. 2020 Oct 1;1866(10):165878. doi: 10.1016/j.bbadis.2020.165878. Epub 2020 Jun 13.
- Ke Z. et al. Structures and distributions of SARS-CoV-2 spike proteins on intact virions. Nature. 2020 Dec;588(7838):498-502. doi: 10.1038/s41586-020-2665-2. Epub 2020 Aug 17.
- Bezstarosti K. et al. Targeted proteomics as a tool to detect SARS-CoV-2 proteins in clinical specimens. PLoS ONE 16(11): e0259165. https://doi.org/10.1371/journal.pone.0259165.
- Zhu N. et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med. 2020 Feb 20;382(8):727-733. doi: 10.1056/NEJMoa2001017. Epub 2020 Jan 24.
- OMS (2020). https://www.who.int/news-room/commentaries/detail/modes-of-transmission-of-virus-causing-covid-19-implications-for-ipc-precaution-recommendations. Dernier accès mars 2023.
- Chan JF. et al. A familial cluster of pneumonia associated with the 2019 novel coronavirus indicating person-to-person transmission: a study of a family cluster. Lancet. 2020 Feb 15;395(10223):514-523. doi: 10.1016/S0140-6736(20)30154-9. Epub 2020 Jan 24.
- Lauer SA et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) From Publicly Reported Confirmed Cases: Estimation and Application. Ann Intern Med. 2020 May 5;172(9):577-582. doi: 10.7326/M20-0504. Epub 2020 Mar 10.
- Zhou R et al. Viral dynamics in asymptomatic patients with COVID-19. Int J Infect Dis. 2020 Jul;96:288-290. doi: 10.1016/j.ijid.2020.05.030. Epub 2020 May 11.
- He X. at al. Temporal dynamics in viral shedding and transmissibility of COVID-19. Nat Med. 2020 May;26(5):672-675. doi: 10.1038/s41591-020-0869-5. Epub 2020 Apr 15.
- Mizumoto K. et al. Estimating the asymptomatic proportion of coronavirus disease 2019 (COVID-19) cases on board the Diamond Princess cruise ship, Yokohama, Japan, 2020. Euro Surveill. 2020 Mar;25(10):2000180. doi: 10.2807/1560-7917.ES.2020.25.10.2000180.
- Gao M. et al. A study on infectivity of asymptomatic SARS-CoV-2 carriers. Respir Med. 2020 Aug;169:106026. doi: 10.1016/j.rmed.2020.106026. Epub 2020 May 13.
- Yu P. et al. A Familial Cluster of Infection Associated With the 2019 Novel Coronavirus Indicating Possible Person-to-Person Transmission During the Incubation Period. J Infect Dis. 2020 May 11;221(11):1757-1761. doi: 10.1093/infdis/jiaa077.
- Liu Z. et al. The assessment of transmission efficiency and latent infection period in asymptomatic carriers of SARS-CoV-2 infection. Int J Infect Dis. 2020 Oct;99:325-327. doi: 10.1016/j.ijid.2020.06.036. Epub 2020 Jun 13.
- Ji T. et al. Detection of COVID-19: A review of the current literature and future perspectives. Biosens Bioelectron. 2020 Oct 15;166:112455. doi: 10.1016/j.bios.2020.112455. Epub 2020 Jul 21.
- OMS (2020). https://www.who.int/publications/i/item/diagnostic-testing-for-sars-cov-2. Dernier accès mars 2023.
- OMS (2020). https://www.who.int/news-room/commentaries/detail/advice-on-the-use-of-point-of-care-immunodiagnostic-tests-for-covid-19. Dernier accès mars 2023.
- Center for Didease Control and Prevention (2020). https://www.cdc.gov/coronavirus/2019-ncov/lab/resources/antigen-tests-guidelines.html. Dernier accès mars 2023.
- Bullard J. et al. Predicting Infectious Severe Acute Respiratory Syndrome Coronavirus 2 From Diagnostic Samples. Clin Infect Dis. 2020 Dec 17;71(10):2663-2666. doi: 10.1093/cid/ciaa638.
- Wölfel R. et al. Virological assessment of hospitalized patients with COVID-2019. Nature. 2020 May;581(7809):465-469. doi: 10.1038/s41586-020-2196-x. Epub 2020 Apr 1.
- OMS (2020). https://apps.who.int/iris/handle/10665/332451. Dernier accès mars 2023.
- Weiss A. et al. Spatial and temporal dynamics of SARS-CoV-2 in COVID-19 patients: A systematic review and meta-analysis. EBioMedicine. 2020 Aug;58:102916. doi: 10.1016/j.ebiom.2020.102916. Epub 2020 Jul 22.
- Sethuraman N. et al. Interpreting Diagnostic Tests for SARS-CoV-2. JAMA. 2020 Jun 9;323(22):2249-2251. doi: 10.1001/jama.2020.8259.
- Zou L. et al. SARS-CoV-2 Viral Load in Upper Respiratory Specimens of Infected Patients. N Engl J Med. 2020 Mar 19;382(12):1177-1179. doi: 10.1056/NEJMc2001737. Epub 2020 Feb 19.
- Larremore DB. et al. Test sensitivity is secondary to frequency and turnaround time for COVID-19 surveillance. medRxiv. 2020 Sep 8;2020.06.22.20136309. doi: 10.1101/2020.06.22.20136309. Preprint.
- Mina MJ. et al. Rethinking Covid-19 Test Sensitivity - A Strategy for Containment. N Engl J Med. 2020 Nov 26;383(22):e120. doi: 10.1056/NEJMp2025631. Epub 2020 Sep 30.
- Fiche technique Elecsys SARS-COV-2 antigen test pour cobas e 411, e 601 et e 602, v 2.0, 12/2022
- Fiche technique Elecsys SARS-COV-2 antigen test pour cobas e 402 et e 801, v 2.0, 10/2021
- Test cobas® SARS-CoV-2, test qualitatif destiné à une utilisation sur les systèmes cobas® 6800/8800. Fiche méthodologique, v7.0, 05/2021
Elecsys® SARS‑CoV‑2 Antigen est un test immunologique pour la détection qualitative in vitro de l’antigène de la nucléocapside du coronavirus 2 du syndrome respiratoire aigu sévère (SARS‑CoV‑2) dans des écouvillons nasopharyngés, oropharyngés et nasaux provenant de patients présentant des signes cliniques et des symptômes indicateurs d’une infection COVID‑19, ou d’une exposition connue ou suspectée au SARS‑CoV‑2. Le test est une aide au diagnostic d’une infection par le SARS‑CoV‑2. Ce test par électrochimiluminescence « ECLIA » s’utilise sur les systèmes d'immunoanalysecobas e.
Dispositif médical de diagnostic in vitro.
Fabricant : Roche Diagnostics GmbH (Allemagne) – Distributeur : Roche Diagnostics France
Lire attentivement les instructions figurant dans la fiche technique
Etabli : 03/2023