SARS-CoV-2:ウイルスの構造、感染、検出の概要
COVID-19の起因ウイルスであるSARS-CoV-2は、一本鎖RNAをウイルスゲノムとして有するエンベロープウイルスです。1-3 これまで7種類のコロナウイルスがヒト感染症の病原体として同定されており、軽度の感冒症状から重度の呼吸不全にわたる疾患を引き起こします。4 コロナウイルスは、スパイク(S)、エンベロープ(E)、メンブレン(M)、ヌクレオカプシド(N)の4つの構造タンパク質を共通して有しており、そのうちのNタンパク質が最も多く存在します。5-8
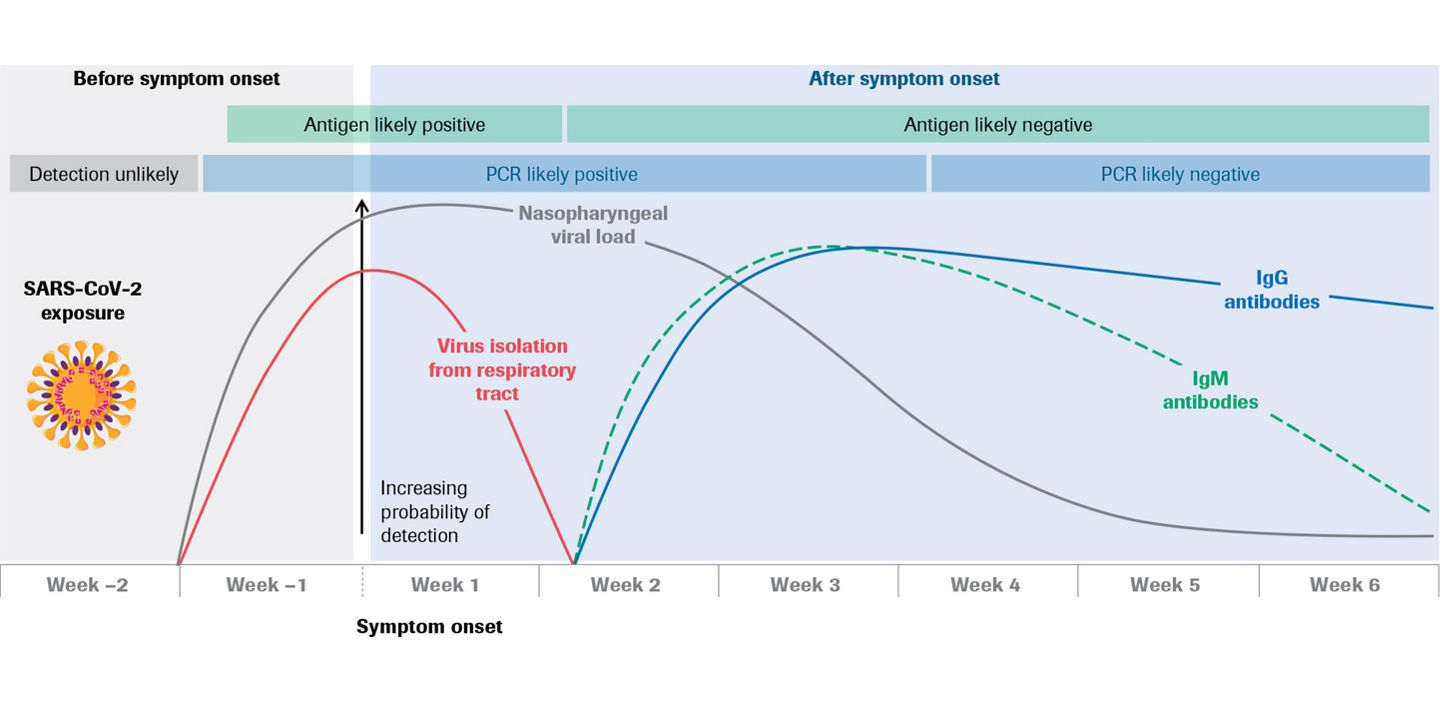
SARS-CoV-2は、主に呼吸器から生じる飛沫やエアロゾルを介して人から人に感染します。9,10 感染後、検出可能となるウイルス量に達するまでの期間は、おおむね2日~14日です。11,12 ウイルスの検出は臨床徴候や症状と関連しますが、感染者のうちかなりの割合が無症状や軽症のままです。13-15 COVID-19患者がいつから感染力を有するのかは、まだ明確には判明していませんが、有症状者、無症状者及び発症前のいずれの患者からもウイルス感染することが判明しています。16-18