cobas® Cdiff

Detecte la presencia de C. diff. antes y comience el tratamiento del paciente más rápido
La prueba cobas® Cdiff es una PCR en tiempo real que proporciona resultados exactos a demanda en 20 minutos para la detección de C. diff toxigénico en muestras de heces no formadas de pacientes con sospecha de infección por C. diff (ICD).
cobas® Cdiff
- Permite adoptar precauciones de aislamiento fundamentadas más rápidamente con resultados en solo 20 minutos
- Reducción del riesgo de omitir una infección aguda con una mayor cobertura de la cepa de C. diff toxigénico
- Ampliación de las pruebas de C. diff más allá del laboratorio con conectividad completa del sistema cobas® liat
El sistema cobas® liat permite un diagnóstico rápido y definitivo al combinar una potente tecnología de PCR con un tiempo de respuesta rápido, de 20 minutos o menos, lo que permite que la muestra proporcione respuestas mientras los pacientes esperan.
Rendimiento de la prueba cobas® Cdiff
Ver la tabla enteraRendimiento de la prueba cobas® Cdiff
| Sensibilidad* | Especificidad* | |
|---|---|---|
| Cdiff LOD: 45-90 CFU/exudado |
93,5 % (IC95 %: 88,1-96,5 %) |
96,4 % (IC95 %: 94,6-97,7 %) |
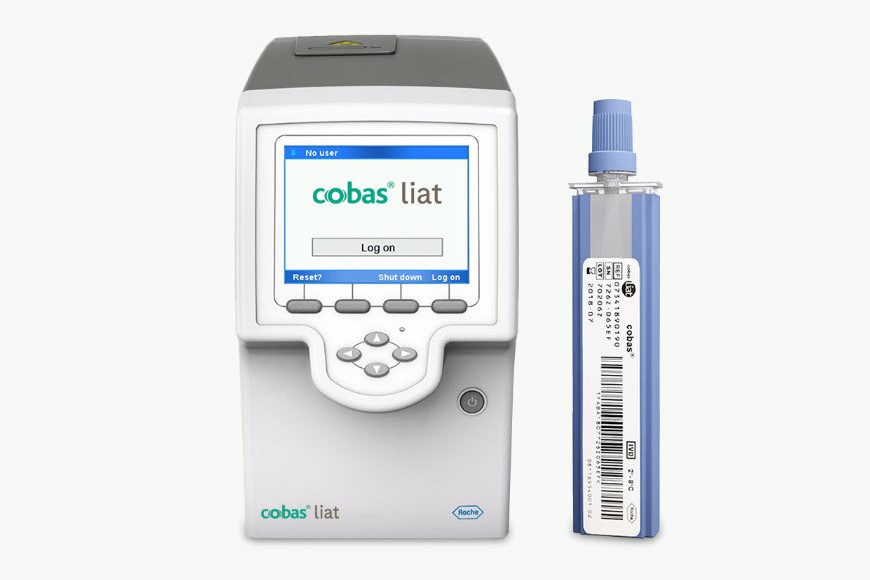
Sistema cobas® liat
Haga pruebas, clasifique y trate rápidamente a sus pacientes con la precisión, sencillez y seguridad necesarias en el lugar de atención.
Métodos de ensayo tradicionales frente al sistema cobas® liat
Los métodos de diagnóstico tradicionales son lentos, laboriosos o poco precisos cuando se utilizan solos. Se han desarrollado algoritmos de prueba para superar las deficiencias de los métodos individuales. Sin embargo, estos algoritmos son complejos y pueden introducir retrasos en la notificación de los resultados, lo que puede afectar negativamente al tratamiento del paciente.
Métodos de ensayo
tradicionales

Paciente con síntomas de ICD

Aislar

Recoger la muestra y enviarla al laboratorio

Procesar con PCR en laboratorio o algoritmo EIA

Resultados positivos: iniciar tratamiento con antibióticos
Resultados negativos: ingresar al paciente sin aislamiento y buscar otras etiologías de los síntomas
Prueba cobas®
Cdiff

Paciente con síntomas de ICD

Recoger la muestra y enviarla al laboratorio

El sistema cobas® liat proporciona resultados exactos en solo 20 minutos

Resultados positivos: aislar e iniciar tratamiento con antibióticos
Resultados negativos: ingresar al paciente sin aislamiento y buscar otras etiologías de los síntomas
Detecte la presencia de C. diff. antes con cobas® Cdiff para transformar la vía asistencial.
Los profesionales sanitarios confían en los resultados rápidos y precisos de cobas® Cdiff y ahora pueden optimizar el diagnóstico de ICD para reducir el aislamiento innecesario y el uso empírico de antibióticos y adoptar las medidas adecuadas de control de infecciones.
Uso previsto
La prueba de ácidos nucleicos cobas® Cdiff para su uso en el sistema cobas® Liat® es una prueba de diagnóstico in vitro cualitativa y automatizada que utiliza la reacción en cadena de la polimerasa (PCR) en tiempo real para la detección del gen toxina B (tcdB) del Clostridioides difficile toxigénico en muestras de heces sin formar (líquidas o blandas) obtenidas de pacientes con sospecha de infección por C. difficile (ICD). La prueba de ácidos nucleicos cobas® Cdiff para su uso en el sistema cobas® Liat® está indicada para su uso como ayuda en el diagnóstico de ICD en humanos en combinación con factores de riesgo clínicos y epidemiológicos.
El sistema cobas® liat se comercializa en algunos mercados. Este producto no está registrado como diagnóstico in vitro (IVD) en todos los países; puede obtener más información de su representante de ventas de Roche.
Estado de registro
CE-IVD, aprobado por la FDA 510(K)
El sistema cobas® liat se comercializa en algunos mercados. Este producto no está registrado como diagnóstico in vitro (IVD) en todos los países; puede obtener más información de su representante de ventas de Roche.
Instrucciones de uso
Acceda a las instrucciones de uso a través del sitio web de Roche Diagnostics de su país.
Referencias
- https://cdifffoundation.org/2014/11/24/c-difficile-infection-cdi-european-clinician-consensus-report-with-recommendations-for-improved-management-of-cdi, accessed on Nov, 2023.
- Gupta A, et. al. Extraintestinal Clostridium difficile infections: a single-center experience. Mayo Clin Proc. 2014 Nov;89(11):1525-36. doi: 10.1016/j.mayocp.2014.07.012. Epub 2014 Sep 20. PMID: 25245597.
- cobas® Cdiff [package insert v4], Pleasanton, CA; Roche Molecular Systems, Inc., 2022
COBAS y LIAT son marcas registradas de Roche.

